Arrhenius ligningskalkulator
Indtast værdi og klik på Beregn.Resultatet vises .
Hvad er en Arrhenius-ligningsberegner?
En Arrhenius-ligningsberegner er et værktøj, der bruges til at bestemme temperaturens effekt på reaktionshastigheder i kemiske og biologiske systemer. Den anvender Arrhenius-ligningen, som udtrykker forholdet mellem hastighedskonstanten (k) for en reaktion og temperatur (T):
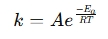
hvor:
- k = hastighedskonstant (1/s, 1/M·s osv.)
- A = præ-eksponentiel faktor (hyppighed af kollisioner)
- Ea = aktiveringsenergi (J/mol)
- R = universel gaskonstant (8,314 J/mol·K)
- T = absolut temperatur (Kelvin)
En omarrangeret form bruges ofte til at sammenligne reaktionshastigheder ved forskellige temperaturer:
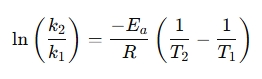
Hvorfor bruge en Arrhenius-ligningsberegner?
- Forudsiger reaktionshastigheder: Hjælper kemikere og ingeniører med at vurdere, hvor hurtigt en reaktion vil forløbe ved forskellige temperaturer.
- Beregner aktiveringsenergi: Beregner den energi, der kræves for, at en reaktion kan forekomme.
- Væsentligt i industriel kemi: Anvendes inden for farmaceutiske produkter, polymervidenskab og materialeteknik.
- Understøtter miljøundersøgelser: Evaluerer temperaturpåvirkninger på biologiske og atmosfæriske reaktioner.
Hvordan fungerer en Arrhenius-ligningsberegner?
-
Input påkrævet:
- Aktiveringsenergi (Ea) i J/mol
- Temperatur(er) i Kelvin (T1,T2)
- Præeksponentiel faktor (A) (valgfrit)
- Hastighedskonstant ved én temperatur (k1) (valgfrit)
-
Behandler:
- Beregner hastighedskonstanten (k) ved hjælp af Arrhenius-ligningen.
- Alternativt beregner aktiveringsenergi (Ea) ud fra kendte hastighedskonstanter.
- Bruger logaritmiske transformationer til sammenlignende beregninger.
-
Output:
- Reaktionshastighedskonstant (k) ved en given temperatur.
- Aktiveringsenergi (Ea), hvis man løser det.
- Ændring i reaktionshastighed med temperaturen.
Hvornår skal man bruge en Arrhenius-ligningsberegner?
- I kemi og kinetik: Forståelse af, hvordan temperatur påvirker reaktionshastigheder.
- I farmaceutisk udvikling: Undersøgelse af lægemiddelstabilitet og nedbrydningshastigheder.
- I industriel proceskontrol: Design af temperaturfølsomme kemiske reaktioner.
- I miljøvidenskab: Forudsigelse af reaktionshastigheder i klimaundersøgelser og atmosfærisk kemi.
Hjælpede denne lommeregner dig?
Tak for feedback


Søgeberegner
Udforsk tusindvis af gratis regnemaskiner, som millioner af mennesker har tillid til verden over.