Calculadora de ecuaciones de Arrhenius
Ingrese el valor y haga clic en Calcular.El resultado se mostrará .
¿Qué es una calculadora de ecuaciones de Arrhenius?
an Calculadora de la ecuación de Arrhenius es una herramienta utilizada para determinar el efecto de la temperatura sobre las velocidades de reacción en sistemas químicos y biológicos. Aplica la ecuación Arrhenius , que expresa la relación entre la constante de velocidad (k) de una reacción y temperatura (t):
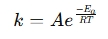
donde:
- k = tasa constante (1/s, 1/m · s, etc.)
- a = factor pre-exponencial (frecuencia de colisiones)
- ea = energía de activación (j/mol)
- r = constante de gas universal (8.314 j/mol · k)
- t = temperatura absoluta (kelvin)
Una forma reorganizada a menudo se usa para comparar las velocidades de reacción a diferentes temperaturas:
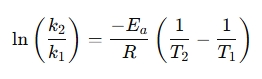
¿Por qué usar una calculadora de ecuaciones de Arrhenius?
- predice las velocidades de reacción : ayuda a los químicos e ingenieros a estimar qué tan rápido procederá una reacción a diferentes temperaturas.
- determina la energía de activación : calcula la energía requerida para que ocurra una reacción.
- Esencial en la química industrial : utilizado en productos farmacéuticos, ciencia de polímeros e ingeniería de materiales.
- apoya los estudios ambientales : evalúa los efectos de la temperatura sobre las reacciones biológicas y atmosféricas.
¿Cómo funciona una calculadora de ecuación de Arrhenius?
-
Entrada requerida :
- Energía de activación (EA) en j/mol
- Temperatura (s) en Kelvin (T1, T2)
- Factor pre-Exponencial (a) (opcional)
- Vedia constante a una temperatura (K1) (opcional)
-
procesamiento :
- calcula la velocidad constanteAnt (k) usando la ecuación de Arrhenius.
- Alternativamente, calcula la energía de activación (EA) a partir de constantes de velocidad conocidas.
- utiliza transformaciones logarítmicas para cálculos comparativos.
-
salida :
- velocidad de reacción constante (k) a una temperatura dada.
- Energía de activación (EA) si lo resuelve.
- Cambio en la velocidad de reacción con la temperatura.
¿Cuándo usar una calculadora de ecuaciones de Arrhenius?
- en química y cinética : comprender cómo la temperatura influye en las velocidades de reacción.
- en desarrollo farmacéutico : estudiar la estabilidad del fármaco y las tasas de degradación.
- en el control de procesos industriales : Diseño de reacciones químicas sensibles a la temperatura.
- en la ciencia ambiental : predecir las tasas de reacción en los estudios climáticos y enQuímica mosférica.
¿Te resultó útil esta calculadora?
Gracias por tus comentarios


Calculadora de búsqueda
Explora miles de calculadoras gratuitas en las que confían millones de personas en todo el mundo.