Kalkulator równania Arrheniusa
Wprowadź wartość i kliknij Oblicz. Wynik zostanie wyświetlony.
Co to jest kalkulator równań Arrheniusa?
Kalkulator równania Arrheniusa jest narzędziem stosowanym do określenia wpływu temperatury na szybkości reakcji w układach chemicznych i biologicznych. Stosuje równanie arrheniusa , które wyraża związek między stałą szybkości (k) reakcji a temperaturą (t):
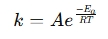
gdzie:
- K = stała szybkości (1/s, 1/m · s itp.)
- A = Współczynnik przedefektywny (częstotliwość zderzeń)
- EA = Energia aktywacji (J/mol)
- r = uniwersalna stała gazu (8,314 j/mol · k)
- T = temperatura bezwzględna (Kelvin)
Często stosowana jest forma przegrupowana do porównania szybkości reakcji w różnych temperaturach:
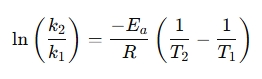
Dlaczego warto używać kalkulatora równania Arrheniusa?
- przewiduje szybkości reakcji : pomaga chemikom i inżynierom oszacować, jak szybko reakcja będzie kontynuowana w różnych temperaturach.
- określa energię aktywacji : Oblicza energię wymaganą do wystąpienia reakcji.
- Niezbędne w chemii przemysłowej : stosowane w farmaceutycznych, polimerowych inżynierii i inżynierii materiałowej.
- wspiera badania środowiskowe : ocenia wpływ temperatury na reakcje biologiczne i atmosferyczne.
Jak działa kalkulator równań Arrheniusa?
-
Wymagane wejście :
- Energia aktywacyjna (EA) w J/mol
- Temperatury w Kelvin (T1, T2)
- Współczynnik przedeszmowy (a) (opcjonalnie)
- stała szybkości w jednej temperaturze (k1) (opcjonalnie)
-
przetwarzanie :
- Oblicza stawkę stawkiAnt (k) za pomocą równania Arrheniusa.
- Alternatywnie oblicza energię aktywacyjną (EA) ze znanych stałych szybkości.
- używa transformacji logarytmicznych do obliczeń porównawczych.
-
wyjście :
- stała szybkości reakcji (k) w danej temperaturze.
- Energia aktywacyjna (EA), jeśli dla niej rozwiązanie.
- Zmiana szybkości reakcji z temperaturą.
Kiedy użyć kalkulatora równań Arrheniusa?
- w chemii i kinetyce : zrozumienie, w jaki sposób temperatura wpływa na prędkości reakcji.
- w rozwoju farmaceutycznym : Badanie stabilności i degradacji leków.
- W kontroli procesu przemysłowego : Projektowanie reakcji chemicznych wrażliwych na temperaturę.
- w naukach środowiskowych : przewidywanie wskaźników reakcji w badaniach klimatycznych i ATChemia Mosferyczna.
Czy ten kalkulator Ci pomógł?
Dziękujemy za opinię


Wyszukaj kalkulator
Przeglądaj tysiące darmowych kalkulatorów, którym zaufały miliony ludzi na całym świecie.