Arrhenius vienādojuma kalkulators
Ievadiet vērtību un noklikšķiniet uz aprēķināt.Rezultāts tiks parādīts .
Kas ir arrhenius vienādojuma kalkulators?
arrhenius vienādojuma kalkulators ir rīks, ko izmanto, lai noteiktu temperatūras ietekmi uz reakcijas ātrumu ķīmiskajās un bioloģiskajās sistēmās. Tas piemēro arrhenius vienādojumu , kas izsaka sakarību starp reakcijas un temperatūras ātruma konstanti (k) (t):
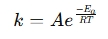
Kur:
- k = ātruma konstante (1/s, 1/m · s utt.)
- A = iepriekšējs faktors (sadursmju biežums)
- ea = aktivizācijas enerģija (j/mol)
- r = universāla gāzes konstante (8.314 J/mol · k)
- t = absolūtā temperatūra (Kelvins)
Pārkārtotu formu bieži izmanto, lai salīdzinātu reakcijas ātrumu dažādās temperatūrās:
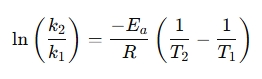
Kāpēc izmantot arrhenius vienādojuma kalkulatoru?
Kā darbojas arrhenius vienādojuma kalkulators?
-
Nepieciešama ievade :
- Aktivizācijas enerģija (EA) J/mol
- Temperatūra (-as) Kelvinā (T1, T2)
- Pirms eksponenciālais faktors (A) (pēc izvēles)
- Ātruma konstante vienā temperatūrā (K1) (pēc izvēles)
-
Apstrāde :
- Aprēķina ātruma constAnt (k), izmantojot Arrhenius vienādojumu.
- Alternatīvi aprēķina aktivizācijas enerģiju (EA) no zināmām ātruma konstantēm.
- Salīdzinošajiem aprēķiniem tiek izmantota logaritmiskās transformācijas.
-
izeja :
- Reakcijas ātruma konstante (k) noteiktā temperatūrā.
- Aktivizācijas enerģija (EA) Ja to risina.
- Reakcijas ātruma izmaiņas ar temperatūru.
Kad jāizmanto arrhenius vienādojuma kalkulators?
- ķīmijā un kinētikā : izpratne par to, kā temperatūra ietekmē reakcijas ātrumu.
- farmaceitiskajā attīstībā : zāļu stabilitātes un degradācijas ātruma izpēte.
- Rūpniecības procesa kontrolē : temperatūras jutīgu ķīmisko reakciju projektēšana.
- Vides zinātnē : reakcijas līmeņa prognozēšana klimata pētījumos un ATMosferikas ķīmija.
Vai šis kalkulators jums palīdzēja?
Paldies par atsauksmi


Meklēšanas kalkulators
Izpētiet tūkstošiem bezmaksas kalkulatoru, kuriem uzticas miljoniem visā pasaulē.