Arrhenius lygties skaičiuoklė
Įveskite vertę ir spustelėkite Apskaičiuoti.Rezultatas bus rodomas .
Kas yra Arrhenius lygties skaičiuoklė?
Arrhenius lygties skaičiuoklė yra įrankis, naudojamas temperatūros poveikiui cheminių ir biologinių sistemų reakcijos greičiui nustatyti. Jis taiko Arrhenius lygtį , kuri išreiškia ryšį tarp reakcijos ir temperatūros greičio konstanta (k) (t):
.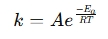
Kur:
- k = greičio konstanta (1/s, 1/m · s ir kt.)
- a = išankstinis eksponentinis faktorius (susidūrimų dažnis)
- ea = aktyvacijos energija (j/mol)
- r = universali dujų konstanta (8,314 j/mol · k)
- t = absoliuti temperatūra (Kelvin)
Pertvarkyta forma dažnai naudojama norint palyginti reakcijos greitį esant skirtingoms temperatūroms:
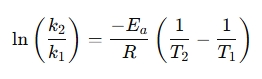
Kodėl reikia naudoti Arrhenius lygties skaičiuoklę?
- prognozuoja reakcijos greitį : padeda chemikams ir inžinieriams įvertinti, kaip greitai reakcija vyks skirtingoje temperatūroje.
- nustato aktyvacijos energiją : apskaičiuoja energiją, reikalingą reakcijai įvykti.
- Esmerat in Pramoninės chemijos : naudojamas vaistuose, polimerų moksle ir medžiagų inžinerijoje.
- palaiko aplinkos tyrimus : įvertinamas temperatūros poveikis biologinėms ir atmosferos reakcijoms.
Kaip veikia Arrhenius lygties skaičiuoklė?
-
reikalingas įvestis :
- Aktyvacijos energija (EA) j/mol
- Temperatūra (-os) Kelvin (T1, T2)
- Išankstinis eksponentinis faktorius (a) (neprivaloma)
- greičio konstanta vienoje temperatūroje (K1) (pasirenkama)
-
Apdorojimas :
- Apskaičiuokite greičio konstANT (k) naudojant Arrhenius lygtį.
- Alternatyviai apskaičiuoja aktyvacijos energiją (EA) nuo žinomų greičio konstantų.
- Lyginamosioms skaičiavimams naudojamos logaritminės transformacijos.
-
išvestis :
- Reakcijos greičio konstanta (k) tam tikroje temperatūroje.
- Aktyvinimo energija (ea), jei išspręsite ją.
- Reakcijos greičio pokytis esant temperatūrai.
Kada naudoti Arrhenius lygties skaičiuoklę?
- chemijoje ir kinetikoje : supratimas, kaip temperatūra daro įtaką reakcijos greičiui.
- farmacijos plėtros srityje : vaistų stabilumo ir skilimo procentų tyrimas.
- pramoninio proceso kontrolėje : temperatūrai jautrių cheminių reakcijų projektavimas.
- Aplinkos mokslo srityje : numatyti reakcijos greitį klimato tyrimuose ir at ATMosferinė chemija.
Ar ši skaičiuoklė jums padėjo?
Dėkojame už atsiliepimą


Paieškos skaičiuotuvas
Naršykite tūkstančius nemokamų skaičiuotuvų, kuriais pasitiki milijonai visame pasaulyje.