Arrhenius ekvationskalkylator
Ange värde och klicka på beräkningen.Resultatet visas .
Vad är en Arrhenius ekvationsräknare?
En Arrhenius ekvationsräknare är ett verktyg som används för att bestämma effekten av temperatur på reaktionshastigheter i kemiska och biologiska system. Den tillämpar Arrhenius-ekvationen, som uttrycker förhållandet mellan hastighetskonstanten (k) för en reaktion och temperatur (T):
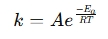
var:
- k = hastighetskonstant (1/s, 1/M·s, etc.)
- A = pre-exponentiell faktor (kollisionsfrekvens)
- Ea = aktiveringsenergi (J/mol)
- R = universell gaskonstant (8,314 J/mol·K)
- T = absolut temperatur (Kelvin)
En omarrangerad form används ofta för att jämföra reaktionshastigheter vid olika temperaturer:
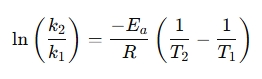
Varför använda en Arrhenius ekvationsräknare?
- Förutsäger reaktionshastigheter: Hjälper kemister och ingenjörer att uppskatta hur snabbt en reaktion kommer att fortgå vid olika temperaturer.
- Bestämmer aktiveringsenergi: Beräknar energin som krävs för att en reaktion ska inträffa.
- Viktigt i industriell kemi: Används inom läkemedel, polymervetenskap och materialteknik.
- Stöder miljöstudier: Utvärderar temperatureffekter på biologiska och atmosfäriska reaktioner.
Hur fungerar en Arrhenius ekvationsräknare?
-
Indata krävs:
- Aktiveringsenergi (Ea) i J/mol
- Temperatur(er) i Kelvin (T1,T2)
- Pre-exponentiell faktor (A) (valfritt)
- Hastighetskonstant vid en temperatur (k1) (valfritt)
-
Bearbetar:
- Beräknar hastighetskonstanten (k) med Arrhenius-ekvationen.
- Alternativt beräknar aktiveringsenergin (Ea) från kända hastighetskonstanter.
- Använder logaritmiska transformationer för jämförande beräkningar.
-
Utdata:
- Reaktionshastighetskonstant (k) vid en given temperatur.
- Aktiveringsenergi (Ea) om man löser det.
- Förändring i reaktionshastighet med temperaturen.
När ska jag använda en Arrhenius ekvationsräknare?
- Inom kemi och kinetik: Förstå hur temperaturen påverkar reaktionshastigheterna.
- Inom läkemedelsutveckling: Studerar läkemedelsstabilitet och nedbrytningshastigheter.
- Inom industriell processkontroll: Utformning av temperaturkänsliga kemiska reaktioner.
- Inom miljövetenskap: Förutsäga reaktionshastigheter i klimatstudier och atmosfärisk kemi.
Hjälp den här kalkylatorn dig?
Tack för feedbacken


Sök kalkylator
Utforska tusentals gratis räknare som miljontals litar på världen över.