Arrhenius -yhtälölaskin
Kirjoita arvo ja napsauta Laske.Tulos näytetään .
Mikä on Arrhenius -yhtälölaskin?
arrhenius -yhtälölaskin on työkalu, jota käytetään lämpötilan vaikutuksen määrittämiseen reaktionopeuksiin kemiallisissa ja biologisissa järjestelmissä. Se soveltaa arrhenius -yhtälöä , joka ilmaisee reaktion ja lämpötilan (t) nopeusvakion (k) välisen suhteen (t):
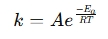
missä:
- k = nopeusvakio (1/s, 1/m · s jne.)
- A = Elepotentiaalinen tekijä (törmäystaajuus)
- ea = aktivointienergia (j/mol)
- r = universaali kaasuvakio (8,314 j/mol · k)
- t = absoluuttinen lämpötila (Kelvin)
Uudelleenjärjesteltyä muotoa käytetään usein reaktionopeuksien vertailuun eri lämpötiloissa:
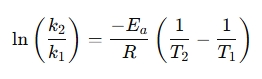
Miksi käyttää Arrhenius -yhtälölaskinta?
- ennustaa reaktionopeudet : Auttaa kemistejä ja insinöörejä arvioimaan, kuinka nopeasti reaktio etenee eri lämpötiloissa.
- määrittelee aktivointienergian : laskee reaktion esiintymiseen tarvittavan energian.
- välttämätön teollisuuskemiassa : Käytetään lääkkeissä, polymeeritieteessä ja materiaalitekniikassa.
- tukee ympäristötutkimuksia : Arvioi lämpötilavaikutukset biologisiin ja ilmakehän reaktioihin.
Kuinka Arrhenius -yhtälölaskin toimii?
-
PUTUS VAATIMUKSET :
- Aktivointienergia (EA) J/Mol
- Lämpötila (t) Kelvinissä (T1, T2)
- Elepotentiaalinen tekijä (a) (valinnainen)
- Nopeusvakio yhdessä lämpötilassa (K1) (valinnainen)
-
prosessointi :
- Complees Protegs ConstAnt (k) Arrhenius -yhtälön avulla.
- Vaihtoehtoisesti laskee aktivointienergian (EA) tunnetuista nopeusvakioista.
- käyttää logaritmisia muunnoksia vertaileviin laskelmiin.
-
lähtö :
- Reaktionopeusvakio (k) tietyssä lämpötilassa.
- Aktivointienergia (EA) Jos ratkaisee sen.
- Reaktionopeuden muutos lämpötilan kanssa.
- kemiassa ja kinetiikassa : kuinka lämpötila vaikuttaa reaktion nopeuksiin.
- farmaseuttisessa kehityksessä : huumeiden stabiilisuuden ja hajoamisasteiden tutkiminen.
- teollisuusprosessin hallinnassa : lämpötilaherkkien kemiallisten reaktioiden suunnittelu.
- ympäristötieteessä : reaktioasteen ennustaminen ilmastotutkimuksissa ja AT: ssäMosfäärin kemia.
milloin käyttää Arrhenius -yhtälölaskin?
Auttoiko tämä laskin sinua?
Kiitos palautteesta


Hakulaskin
Tutustu tuhansiin ilmaisiin laskimiin, joihin miljoonat maailmanlaajuisesti luottavat.